【全】各国汇总 | 局部外用制剂质量评价的法规要求-九游会电竞
局部外用制剂具有可直接作用于患处发挥药效、避免药物的肝首过效应等优点。但由于皮肤屏障的存在,药物通过皮肤角质层较为困难,导致起效慢,且很多药物无法达到有效治疗浓度,因此药物释放量及经皮渗透量的研究至关重要。本文汇总分析了国内外对局部外用制剂仿制药的质量一致性评价要求,以指导药物开发。
「局部外用制剂仿制药的一致性评价要求 」
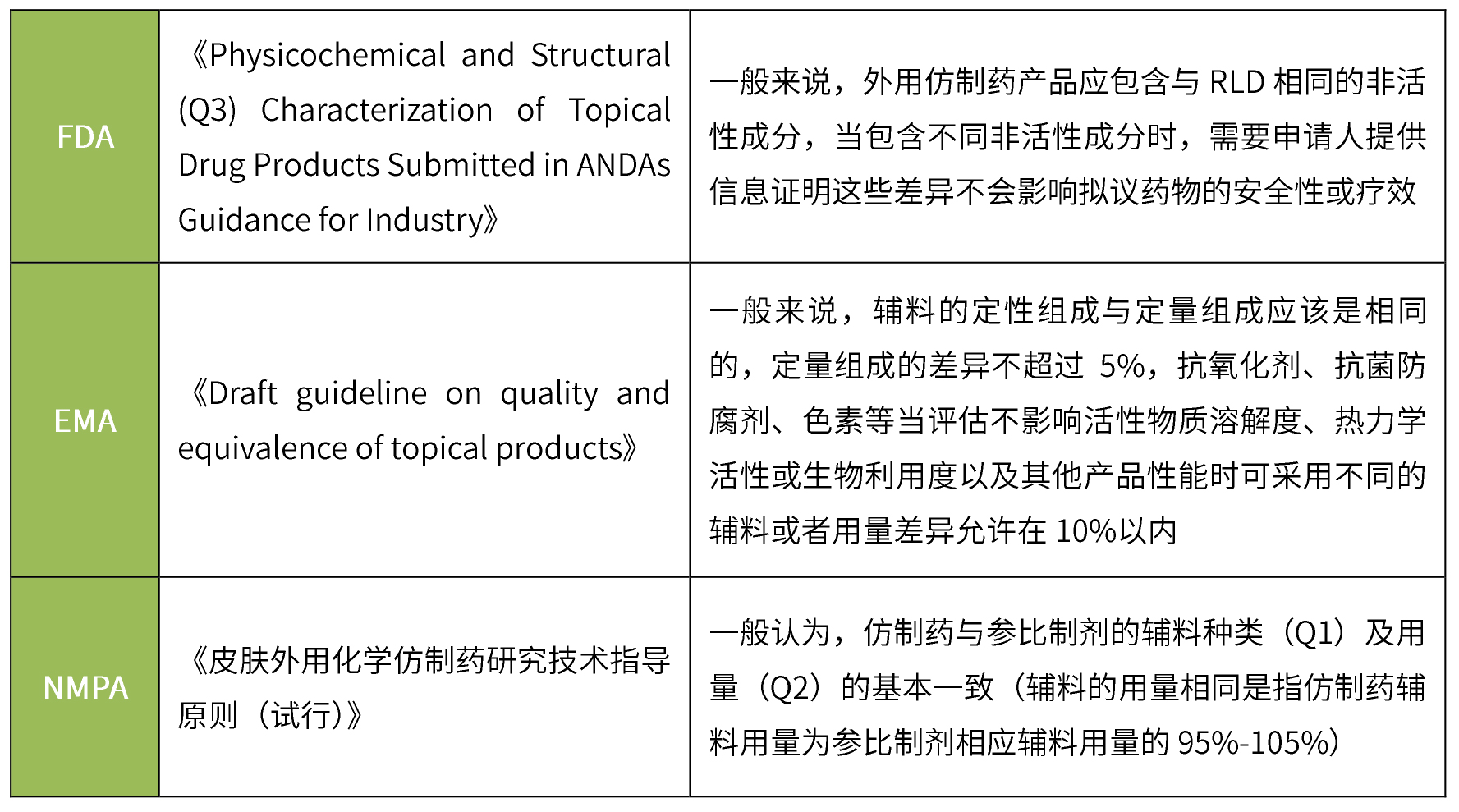
透皮制剂仿制药一般要求与参比制剂的辅料种类及用量一致,无论fda、ema还是nmpa,在对处方组成的要求上大同小异,均要求辅料种类一致、用量基本相同。
根据《皮肤外用化学仿制药研究技术指导原则(试行)》及《新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿)》:
-
软膏剂、凝胶剂在开发过程中需注意对原料药预处理工艺(如微粉化处理)、加入方式及分散手段等进行研究,以保证仿制药与参比制剂中药物晶型、粒度及粒度分布、含量均匀性等关键质量指标的一致。
-
乳膏剂、乳剂需对物料加入的顺序、溶解温度、乳化、剪切速度及混合时间等关键工艺参数进行研究,以保证与参比制剂的质量一致性。
3、质量控制
根据《physicochemical and structural (q3) characterization of topical drug products submitted in andas guidance for industry》:通常建议申请人对照参比制剂对其申请的仿制药进行q3特性比较,并提供可接受的体外释放试验(ivrt)和体外渗透试验(ivpt)的证明。其中基本q3表征通常包括:
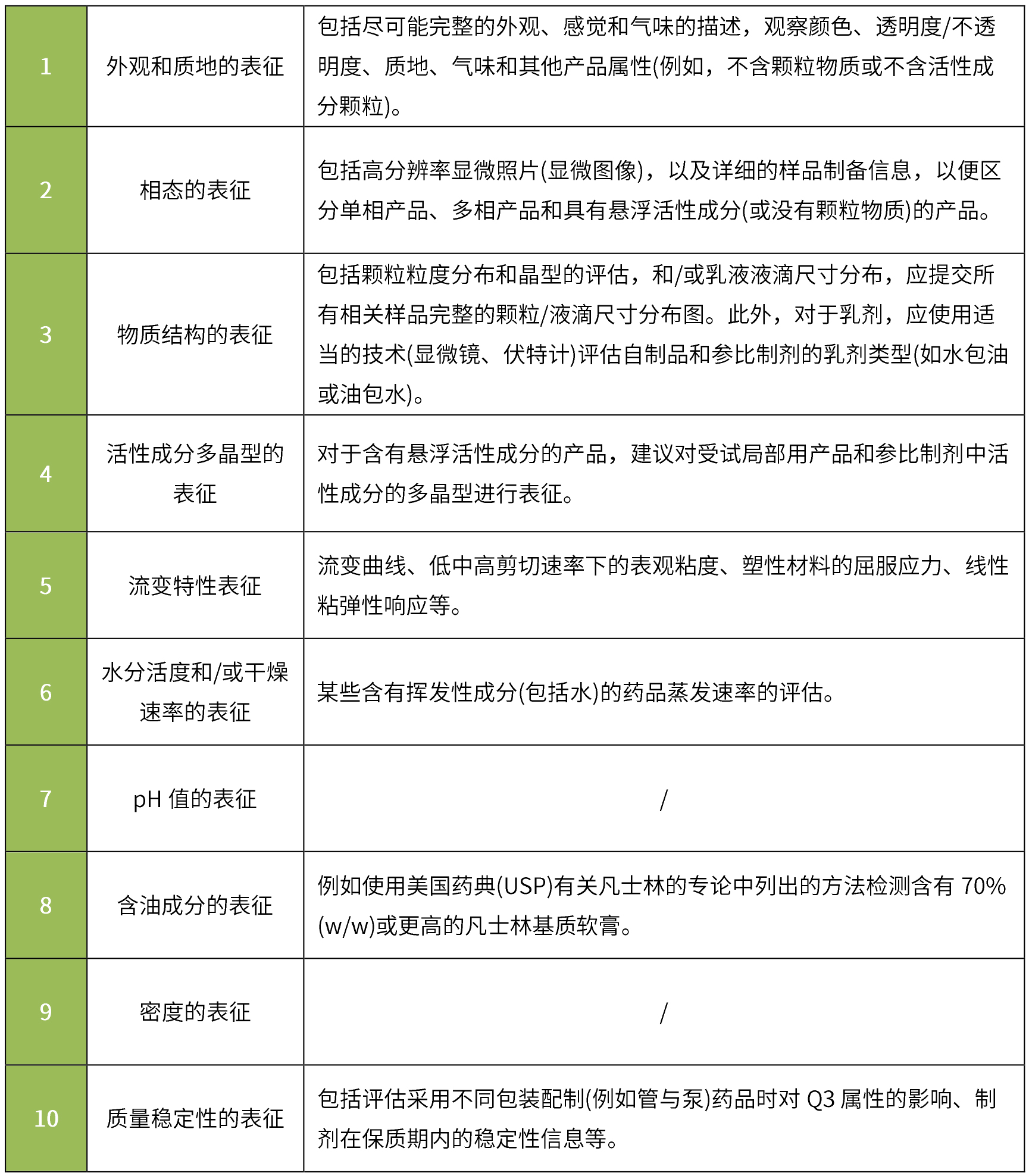
q3相同/相似标准:在多个批次中表征的每个相关q3属性在参比制剂的q3属性表征范围内,或在由官方机构确定的可接受变化范围。
要求与参比制剂进行质量数据的比较,应比较剂型(单相/两相、油包水型/水包油型等)、处方组成的定性和定量、微观结构/物理性质(ph值、粘度、密度、表面张力、渗透压、流变特性等)、产品性能(体外释放试验、药物在皮肤和作用部位的扩散等)。
产品质量等效的对比应在能代表上市产品和生产过程的批次上进行,即达到或接近生产规模的批次。如果制造工艺和设备没有变化,并且提供的证据表明放大不影响产品质量,则可用至少 1/10 生产规模的中试批次来表征和比较,至少应比较三个不同批次的测试产品和参比制剂,为了能够进行统计评估,每个实验的样本数量至少应为每批12个单位。
对于定量质量特性,假设数据呈正态分布,测试产品和比较产品均值差异的90%置信区间应包含在参比制剂均值的 /- 10%的验收标准内。
皮肤外用制剂的关键质量属性一般包括但不限于以下项目:外观、混悬药物的晶型、粒度分布、液滴粒径、流变特性、ph值、黏度、含量均匀度、微生物限度、有关物质、抑菌剂含量及抗氧剂含量、无菌(用于烧伤(除轻度 i°或 ii°外)或严重创伤的无菌制剂)以及体外释放试验(ivrt)和体外透皮试验(ivpt)等。
应对仿制品与参比制剂进行全面的质量对比研究,并提供体外释放对比试验和体外透皮对比试验数据,以证明二者质量的一致性,原则上应提供多批次参比制剂的质量对比研究数据。
外用药物在体外局部释放的程度和速度是制剂性能的综合体现,应提供体外释放试验方法的系统的研究及验证资料,并在此基础上对仿制药与参比制剂进行体外释放度对比研究。(nmpa:新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿))。
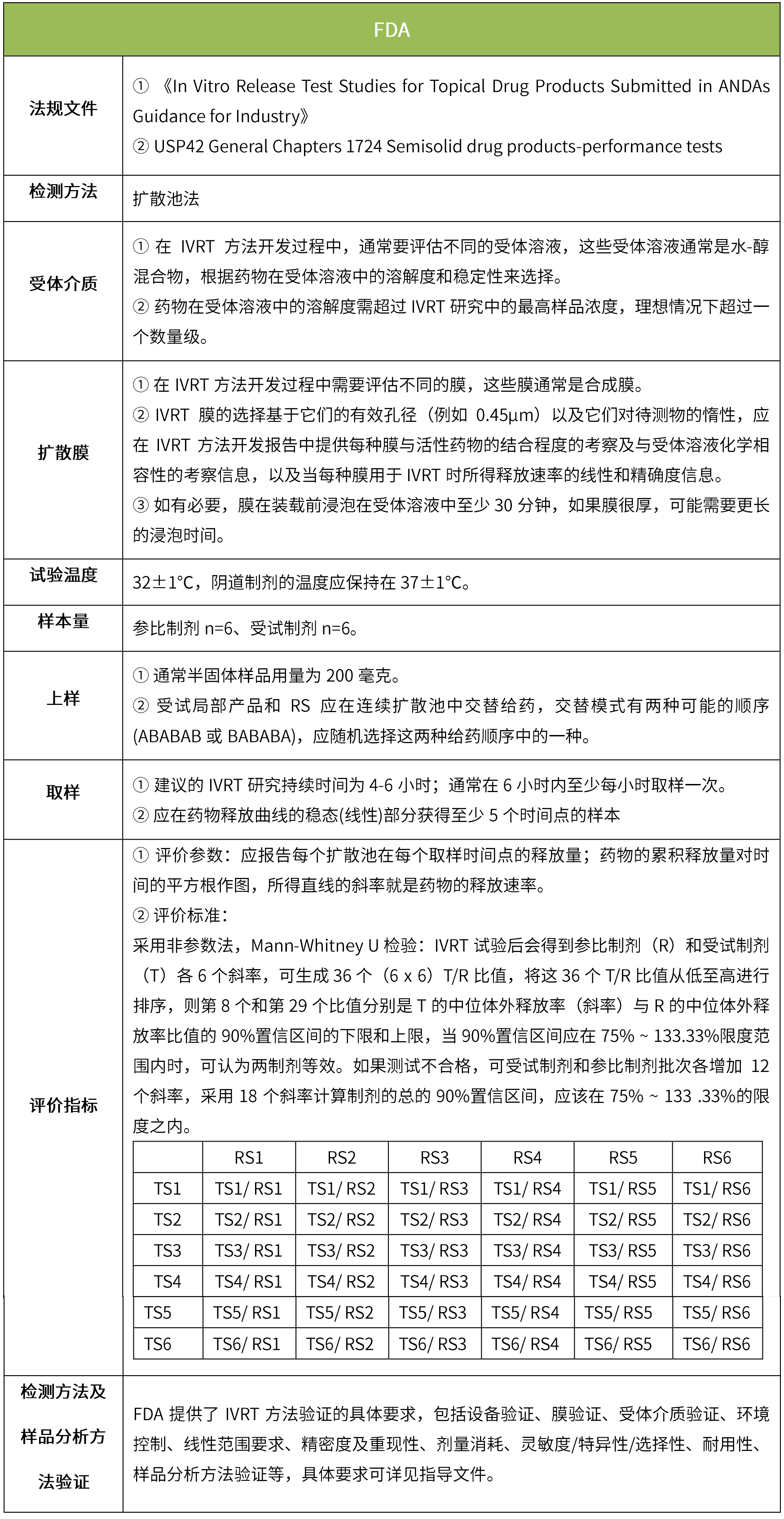
下表汇总了各国法规对ivrt的评价要求。总体而言,各国对试验过程的要求很多都是相同的,评价标准则不同,中国的评价标准在18年征求意见稿时与fda一致,试行版则只提及参考fda、ema、pmda,欧盟和日本的评价标准与fda也不一致。
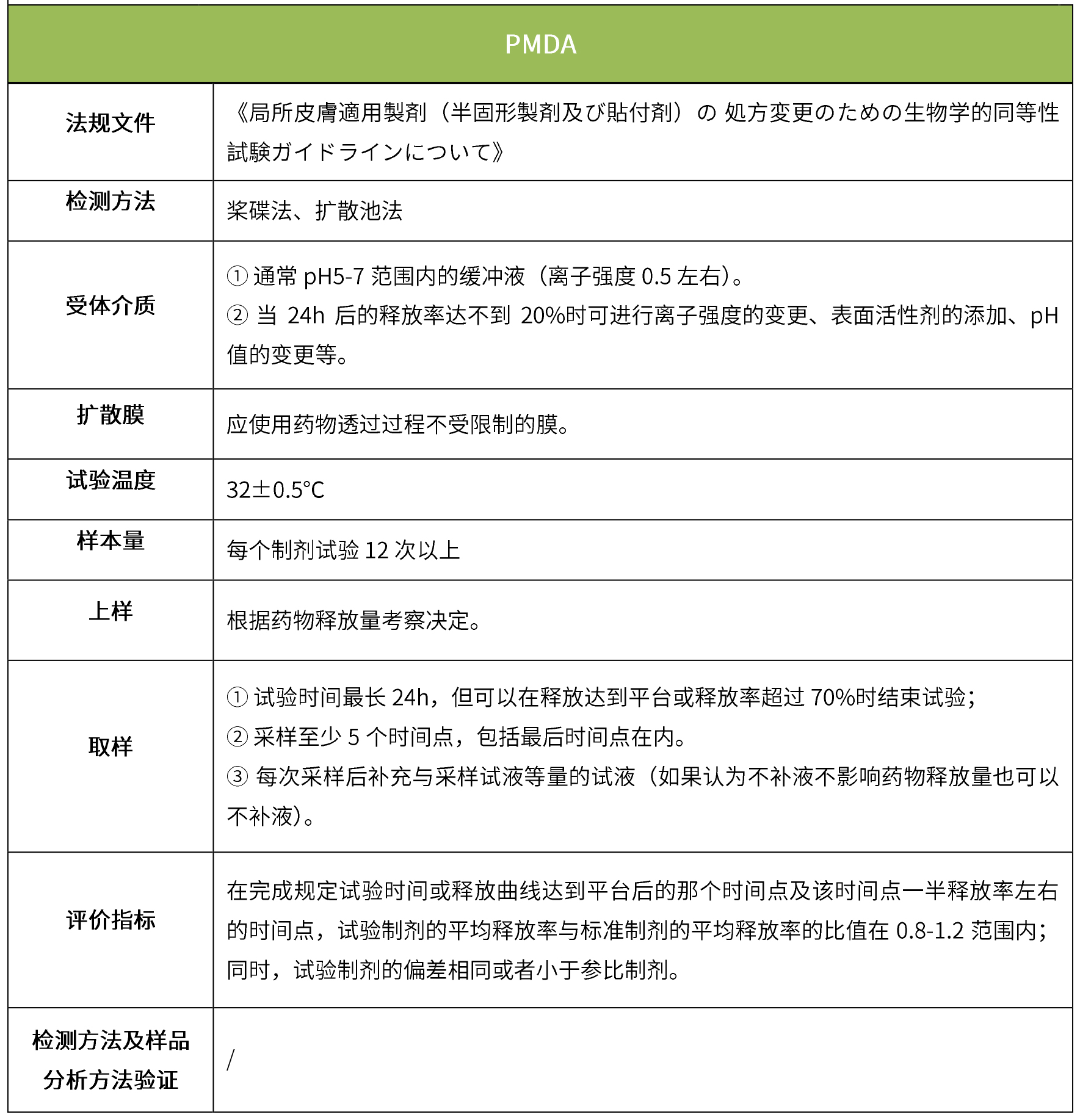
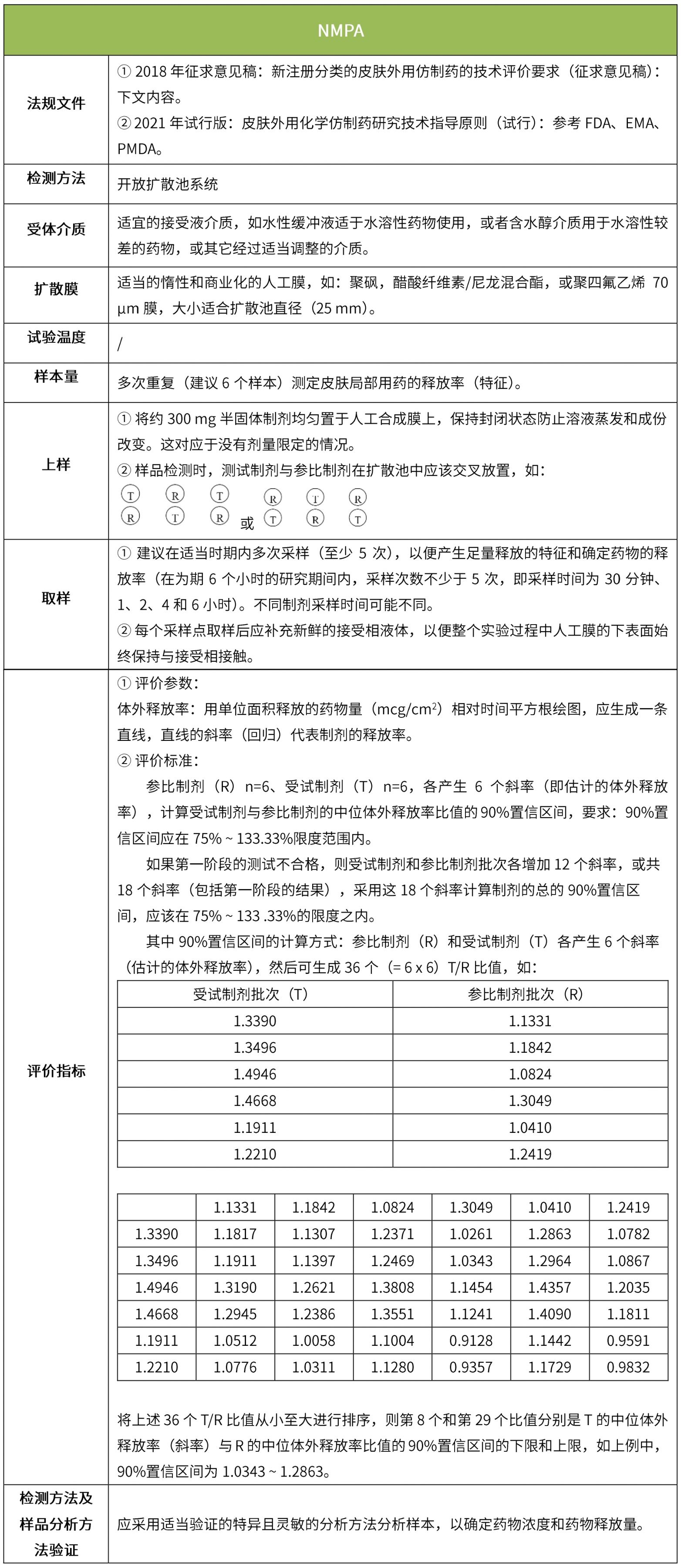
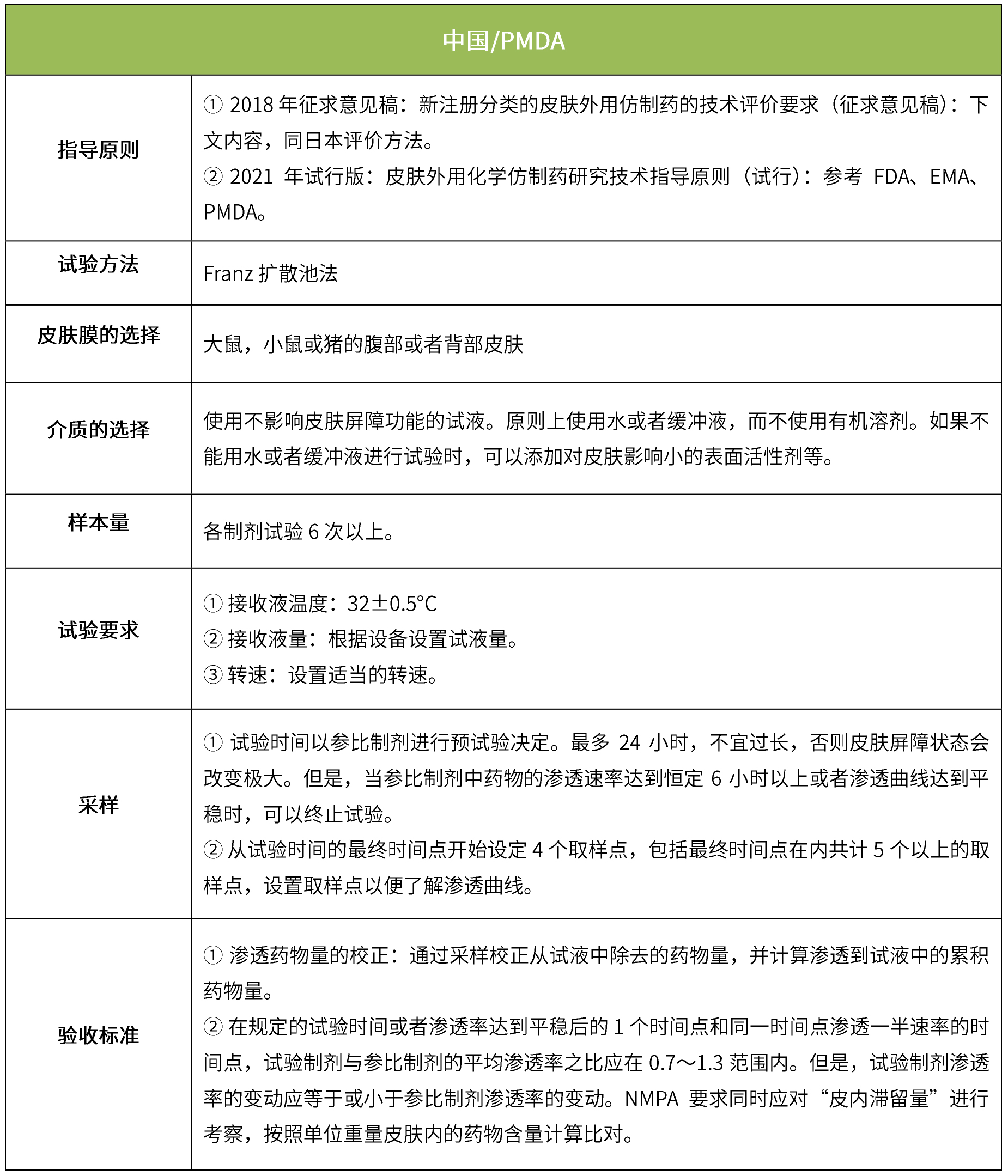
5 ivpt(体外透皮试验)
体外透皮试验的设计目的是模拟外用药物在生理条件下的透皮过程,以反映外用制剂的质量;是采用特定的研究方法,动态地测量皮肤给药后一定时间内药物透过皮肤的速度和药物的量,以测定药物透过皮肤的真实生理效果。(nmpa:《皮肤外用化学仿制药研究技术指导原则(试行)》、《新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿)》)。
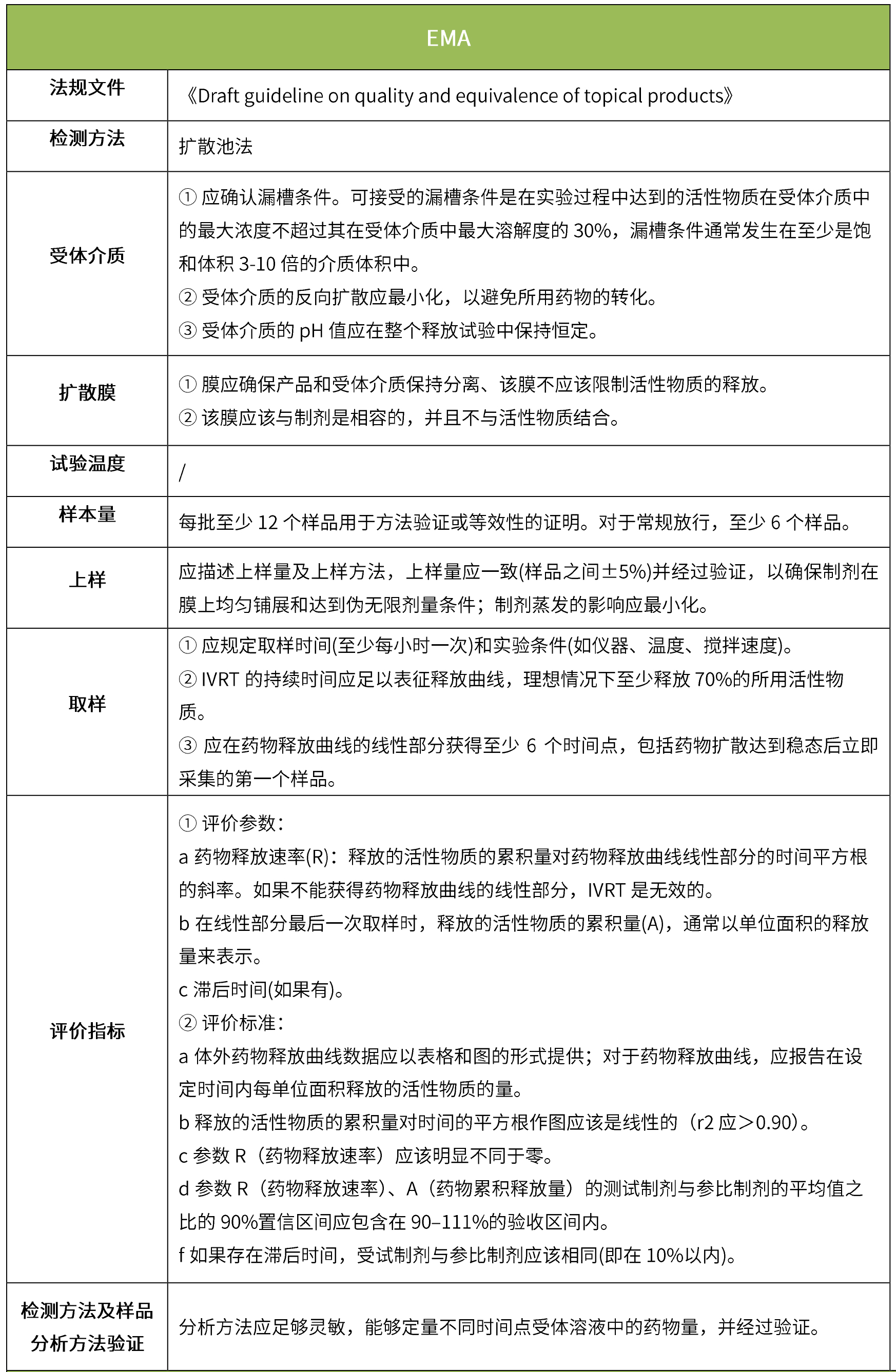
下表汇总了各国法规对ivrt的评价要求。总体而言,各国对该试验过程的要求是不一样的,中国的评价标准在18年征求意见稿时与日本一致,试行版则只提及参考fda、ema、pmda,欧盟与fda相比试验过程要求上大体一致,但在样本量和评价标准上也不一致。
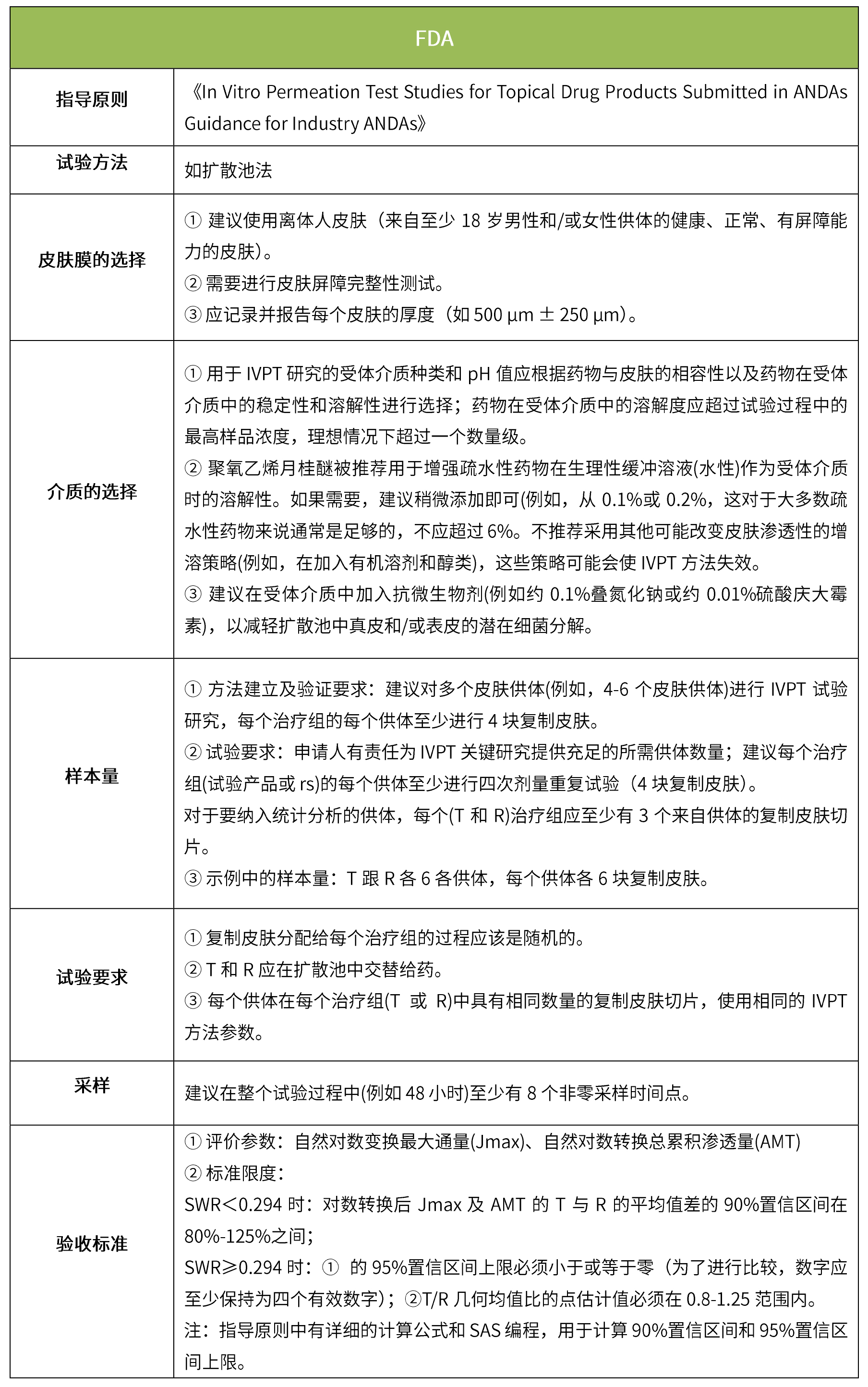
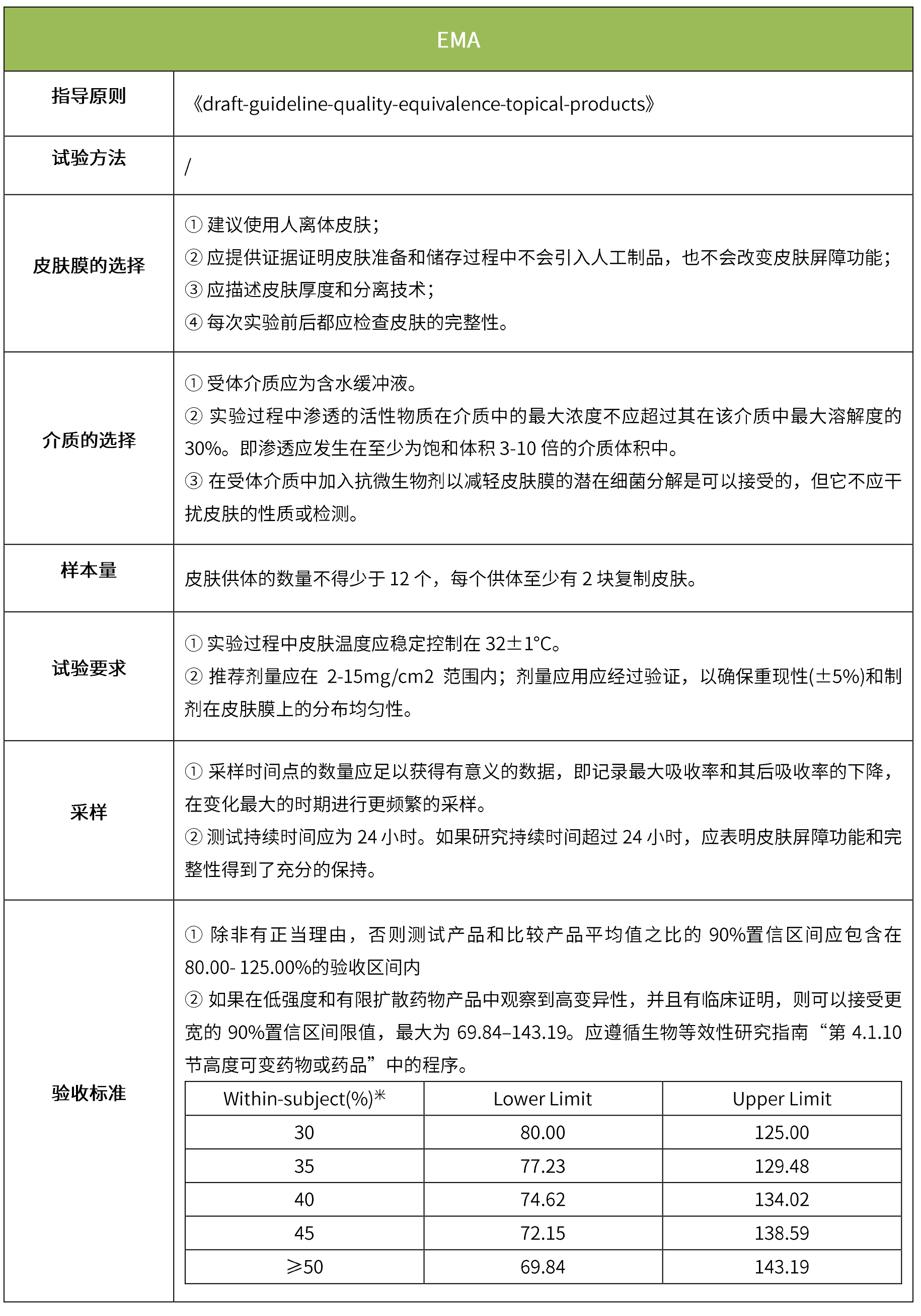
-end-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。
 hotline服务热线:010-61006450
hotline服务热线:010-61006450


 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
